Conoscere per combattere.
Tra i vari organismi patogeni che possono creare problemi ai nostri amati avicoli i parassiti sono un ospite abbastanza comune ma, per nostra fortuna, spesso gestibile ed eradicabile.
Daremo in questo testo informazioni generali per identificare, gestire e conoscere meglio le parassitosi “del pollaio rurale”, dando consigli su come approcciarsi a questi patogeni.
Coccidi
In un precedente articolo abbiamo parlato dei coccidi e del loro impatto sugli animali in maniera estesa, se questo è l’inquilino intestinale che vi preoccupa vi consigliamo di spostarvi su questo link per maggiori informazioni: https://confraternitagallus.com/2023/02/07/coccidi/
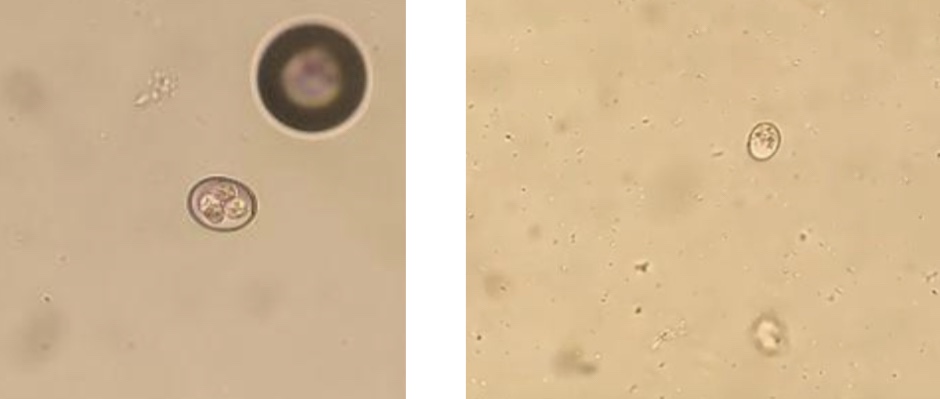
Identificazione e Ciclo
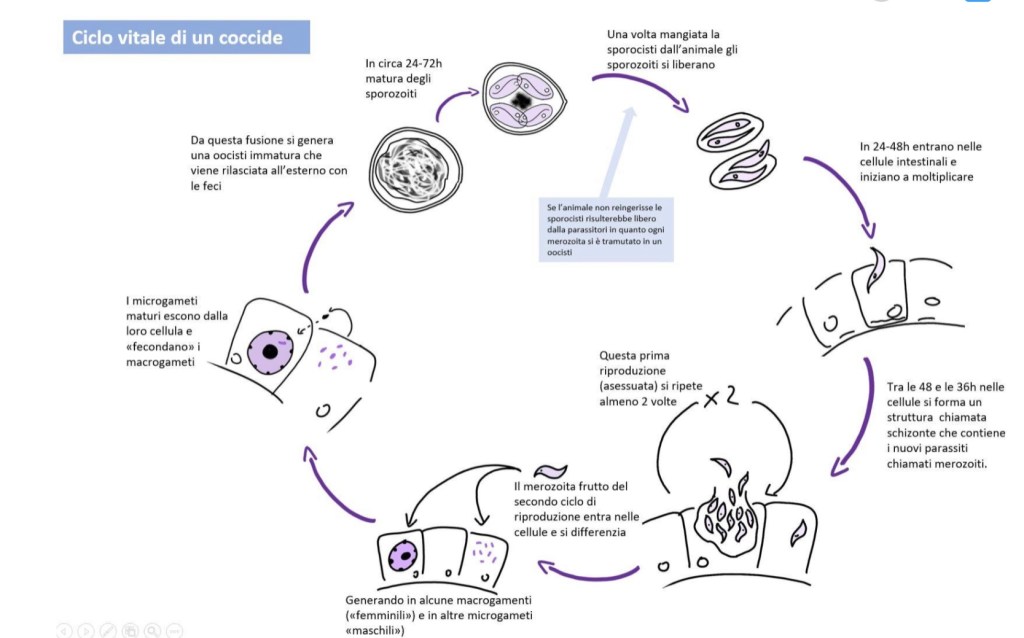
In breve i coccidi sono Protozoi, tipicamente organismi unicellulari. Quelli di interesse veterinario sono parassiti obbligati che sfruttano le cellule intestinali per nutrirsi e riprodursi; facendo questo portano al danneggiamento della cellula stessa con sua conseguente morte.
Pesanti infestazioni portano a grandi superfici di intestino che presentano funzionalità alterata o del tutto persa con perdita di nutrienti, in alcuni casi sangue, e possibilità di ingresso di altri patogeni tramite la mucosa lesionata.
Sintomi
Animali debilitati e abbattuti, in base alla specie di coccidi le feci variano dal diarroico bianco/marrone al giallo, con o senza presenza di macchie di sangue. Nei pulcinotti tra le 3 e le 8 settimane di vita questa parassitosi può portare a mortalità elevate. Gli animali con cloaca imbrattata, abbattuti e con meno stimolo alimentare andrebbero isolati procedendo poi ad un esame parassitologico per flottazione (in cui si evidenzieranno le oocisti presenti in caso di positività). Se possibile sarebbe ideale spostare gli animali su rete per un mese, in modo che non entrino in contatto diretto con le feci e sia più difficile la reinfezione mentre le oocisti ancora presenti nel box di provenienza, che andrà pulito a fondo, andranno incontro a decadimento.
GESTIONE DELLE INFESTAZIONE DA PROTOZOI
Effettuare almeno un parassitologico all’anno (ideale uno in inverno e uno in primavera). Controllare le feci alla visita in pollaio ponendo attenzione a presenza di eccessivo muco, colori alterati e tracce di sangue. Isolare i soggetti sintomatici e trattare con antibiotico (sulfamidici) o antiparassitari adeguato alla loro eliminazione (chiedere al veterinario di fiducia). Fare un test agli animali in box con l’infetto e eventualmente trattare anche loro. Dopo 2 giorni dal trattamento procedere con una pulizia profonda del box che va ripetuta alla fine del trattamento, questo aiuta a eliminare la maggior parte delle oocisti.
Capillaria
Identificazione e Ciclo
Vermi tondi sottili (dimensione varia da specie a specie), situati in: mucosa di esofago e gozzo per C. anulata e C. contorta, poste in intestino tenue e cieco per C. obsign
Annulata: 1-2cm Le uova deposte nella mucosa dell’esofago degli avicoli finiscono poi nelle feci, le uova vengono ingerite da alcune specie di vermi di terra e dentro di loro si sviluppa la larva infettante che le galline ingeriscono insieme al lombrico. (ciclo indiretto con lombrichi come ospite secondario)
Obsignata: vermi sottili di circa 6cm, situati in tenue e cieco, ciclo diretto con uova embrionate che una volta mangiate schiudono nel pollo stesso, in 18 giorni si trovano gli adulti a livello intestinale. Sintomi: gli animali si presentano abbattuti, spesso si isolano nel gruppo e si posizionano negli angoli dei box. Presentano bassa crescita.

Contorta: vermi sottili, situati in mucosa di esofago e gozzo, le uova vengono deposte nella mucosa dell’esofago degli avicoli e finiscono poi nelle feci, in circa un mese divengono infettanti e quando ingerite da altri avicoli sviluppano lentamente parassiti adulti.
Sintoni: Animali con crescita ridotta, deboli con ali portate basse (segno di malessere)
Sintomi: Animali con crescita ridotta, emaciati e deboli

Dispharynx nasuta


Identificazione e Ciclo: piccolo e corto verme, sito in proventriglio (stomaco ghiandolare) le uova larvate schiudono una volta ingerite da degli isopodi, quando la gallina li ingerisce di infesta e gli adulti si infiggono nella mucosa che tende a sviluppare ulcere e lesioni con mucosa ispessita.
Sintomi: bassa indice di crescita e di conversione. In caso di infestazioni gravi, animali pallidi con feci rosso scuro/mattone per sangue digerito (melena).
Ascaridia galli


Identificazione e Ciclo: grosso verme bianco fino a 7cm, chiaramente visibile a occhio nudo e comune ritrovamento come ascaride nei polli. Sito intestino, a volte in esofago e gozzo. Ciclo diretto con animali che si infettano ingerendo le uova contenenti la larva immatura. L’uovo ci mette da 20 a 40 giorni a sviluppare la larvetta infettante. La larva schiusa si pianta nella mucosa più o meno in profondità nei tessuti e in un paio di settimane evolve e gli adulti si posizionano nel lume intestinale.
Sintomi: le infezioni portano a cali di peso, soprattutto in diete proteiche, e possono aggravarsi se vi è presenza di coccidi in contemporanea. Conosciuti molto perché possono essere vettori di reovirus e perché molto raramente vengono ritrovati nelle uova (escono dalla cloaca e migrano nell’uovidutto/perforazione del peritoneo).
Heterakis gallinarum
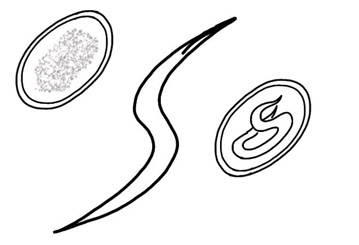

Identificazione e Ciclo: Vermi simili a A. galli ma più piccoli (1 cm) che si posizionano nei ciechi. Il ciclo è diretto con uova embrionate che vengono mangiate dall’ospite oppure “pseudo diretto” con accumulo delle uova nei lombrichi che fungono da ospite paratenico.
Sintomi: negli animali i ciechi si trovano infiammati, con parete ispessita e cali nella crescita degli animali. Se l’animale si infetta una seconda volta si formano sulla parete e a volte sul fegato noduli bianchi, che sono incistamenti della larva che cerca di proteggersi dal sistema immunitario dell’ospite.
NB Questo parassita può essere portatore del protozoo istomonas (Istomoniasi) che si accumula nelle uova di Heterakis e viene emesso con le feci.
Istomonas: Particolarmente di rilievo nel tacchino. Da lesioni intestinali tipiche nei ciechi e sul fegato con focolai infiammatori ad essudato caseoso verde-giallastro e successivamente granulomi epatici bianco/giallastri. Occasionalmente si ha peritonite per ulcerazione dei ciechi. Lesione tipica nel tacchino e la comparsa di aree cianotiche sulla testa (black-head disease).
Trichostrongylus tenuis
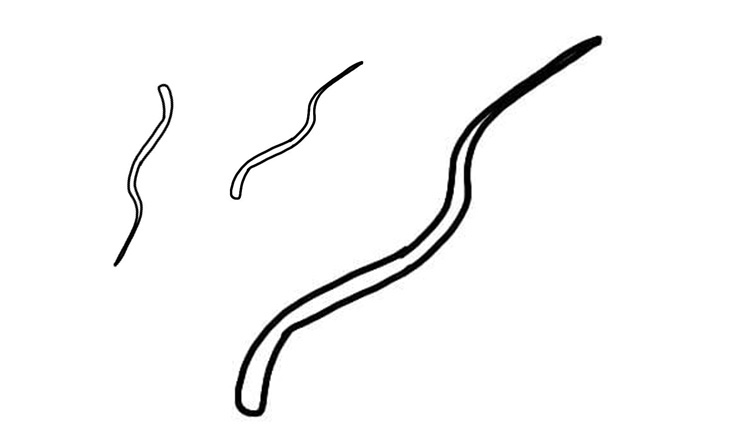
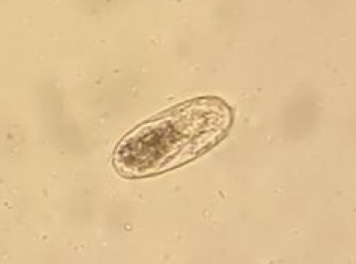
Identificazione e Ciclo: verme dalla testa sottile presente nei ciechi e nel tenue, il ciclo è diretto e con uova che schiudono nell’ambiente e le larve libere diventano infettanti in 2 settimane, da qui se vengono ingerite causano la parassitosi.
Sintomi: Le infezioni possono avere sintomi gravi, 500 larve possono causare la morte nel soggetto soprattutto se giovane. Si possono creare infestazioni croniche, con animali che paiono sani ma in cui si manifesta mortalità in autunno.
Strongyloides spp
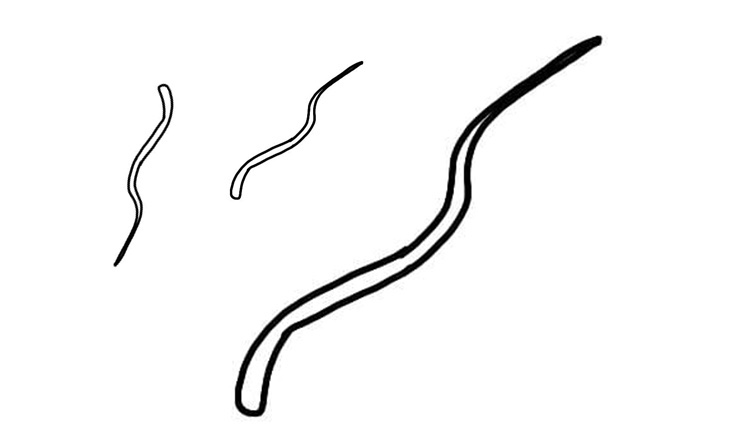
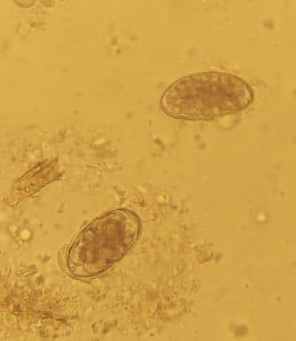
Identificazione e Ciclo: I parassiti appartenenti al genere Strongyloides variano di dimensioni da specie a specie e infettano mammiferi, uccelli, rettili e anfibi. Per i polli nominiamo S. avium e S. oswaldoi, trovati in aree tropicali del sud America).
Come per la maggior parte dei nematodi che parassitano il tratto gastrointestinale i parassiti adulti vivono nell’intestino dell’ospite e le femmine depongono le uova che escono dall’ospite nelle feci. A seconda della specie, uova o larve infettanti che si sviluppano sono il mezzo di trasmissione. Vi è in queste specie generalmente un periodo di migrazione larvale all’interno dell’ospite prima che i nuovi adulti si stabiliscano nell’intestino (che può lasciare cicatrici su alcuni organi, tipicamente il fegato).
Sintomi: I sintomi variano in base alla specie ma in generale troviamo infiammazione intestinale con parete ispessita, feci di consistenza diminuita, cali nella crescita degli animali, malessere e abbattimento.
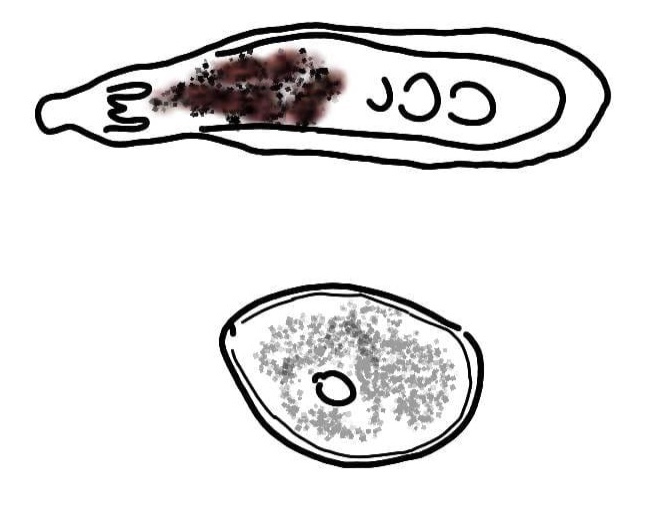
Syngamus trachea
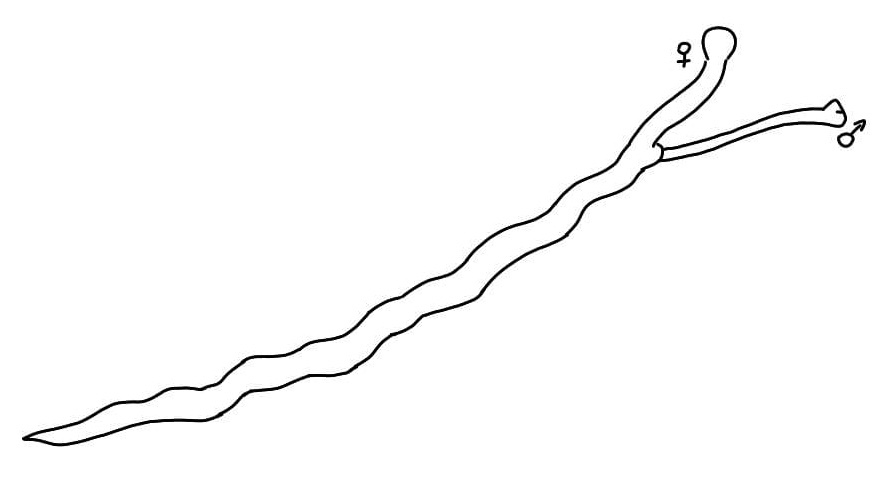

Identificazione e Ciclo: Nematode che colpisce comunemente i polmoni di avicoli e di molti uccelli selvatici. La femmina è di colore rosso intenso e il maschio è bianco. Copulano in modo permanente formando una forma a Y. La larva si sviluppa nell’uovo e l’infezione può avvenire tramite l’ingestione delle uova larvate, delle larve giù schiuse, o l’ingestione di un ospite paratenico, più comunemente il lombrico e la lumaca.
Le larve mature penetrano nell’intestino e poi entrano nei polmoni dove raggiungono lo stadio adulto, la copula avviene nella trachea pochi giorni dopo.
Sintomi: Il parassita provoca respiro affannoso “a bocca aperta”: gli uccelli colpiti allungano il collo, aprono la bocca e boccheggiano generando un suono simile ad un sibilo. Una grave infestazione può ostruire il lume tracheale con conseguente soffocamento. Animali affetti possono anche manifestare tosse, debolezza, emaciazione e scuotimento della testa.
Tetrameres spp


Identificazione e Ciclo: I tetrameri sono nematodi parassiti dello stomaco ghiandolare degli avicoli, il pollame si infesta ingerendo gli ospiti intermedi (artropodi o isopodi) contenenti larve di terzo stadio, la femmina è tondeggiante e di colore rosso intenso e si trovano incorporati nella mucosa gastrica, i maschili si trovano liberi nel lume e sono filiformi.
Sintomi: abbattimento, apatia, anoressia e diarrea
GESTIONE DELLE INFESTAZIONE DA NEMATODI
Insieme ai Protozoi rappresentano uno dei più comuni ritrovamenti del pollaio, visto il discreto potenziale patogeno degli stessi è consigliato porre attenzione particolare agli animali soprattutto se manifestano crescita stentata e diarrea nei primi mesi di vita e alla palpazione hanno la muscolatura del petto scarsa con una carena pronunciata. Tenere la lettiera cambiata regolarmente è un ottimo protocollo di gestione per la buona igiene generale ma anche per il controllo dei parassiti.
Come per i precedenti effettuare un esame parassitologico all’inizio della primavera e dell’inverno è una procedura importante per monitorare lo stato del pollaio e cogliere patologie precocemente.
In caso di parassitosi conclamata contattare il veterinario per la prescrizione del farmaco antielmintico adeguato.
NB: la presenza di vermi bianchi e sottili nelle feci vecchie o nel pollaio può non essere un indicazione di parassitosi, infatti moltissime specie di nematodi hanno vita libera, si nutrono di materiale in decomposizione e detriti e non sono una minaccia per i nostri animali.
Prima di trattare eseguire sempre un esame delle feci (fresche).
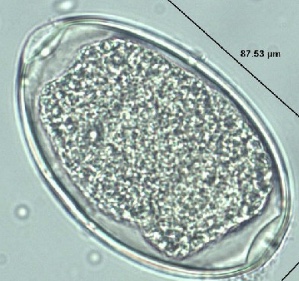
Echinostoma
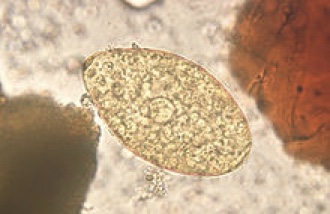
Identificazione e Ciclo: Verme piatto trematode, grande da pochi millimetri a qualche centimetro, il loro ciclo coinvolge sempre una fonte d’acqua dove le uova schiudono e infettano un mollusco (primo ospite intermedio), il parassita può incistarsi nella lumaca o tornare a infettare un nuovo animale (spesso pesci o anfibi) e diventare metacercaria (fase infettante). Stanziato nei climi caldi e tropicali, per quanto poco frequente lo citiamo per il suo interesse per la salute umana in quanto anche l’uomo può ospitare questo patogeno.
Sintomi: Enteriti gravi con feci mucose e calo di crescita e produzione
GESTIONE DEI TREMATODI
Evitare ristagni idrici e non porre le strutture di stabulazione degli animali vicini a stagni o pozze di acqua ferma. Fare un esame parassitologico all’inizio della primavera e dell’inverno è una procedura importante per monitorare lo stato del pollaio e cogliere le patologie precocemente.
In caso di parassitosi conclamata contattare il veterinario per la prescrizione del farmaco adeguato.
Choanotenia infundibulum

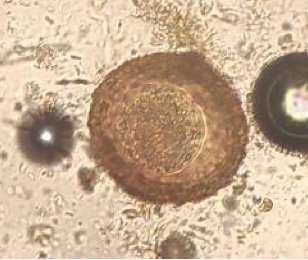
Identificazione e Ciclo: Verme piatto Cestode che infesta il piccolo intestino, raggiunge i 25 cm di lunghezza e si suddivide in 30 segmenti (proglottidi) di cui gli ultimi ospitano uova mature. La testa (scolice) ha ventose con piccoli uncini per l’adesione alla mucosa intestinale. Il ciclo è indiretto con varie specie di insetti come ospite intermedio (mosche, locuste, termiti)
Come gli altri cestodi è ermafrodita (ogni segmento oltre la testa ha organi maschili e femminili che si autofecondano) e non ha un apparato digerente, assorbe infatti i nutrienti direttamente dal tegumento che lo riveste.
Sintomi: Non particolarmente patogeno, massicce infestazioni causano abbattimento, forme da carenza vitaminica, calo della crescita e perdita di peso.
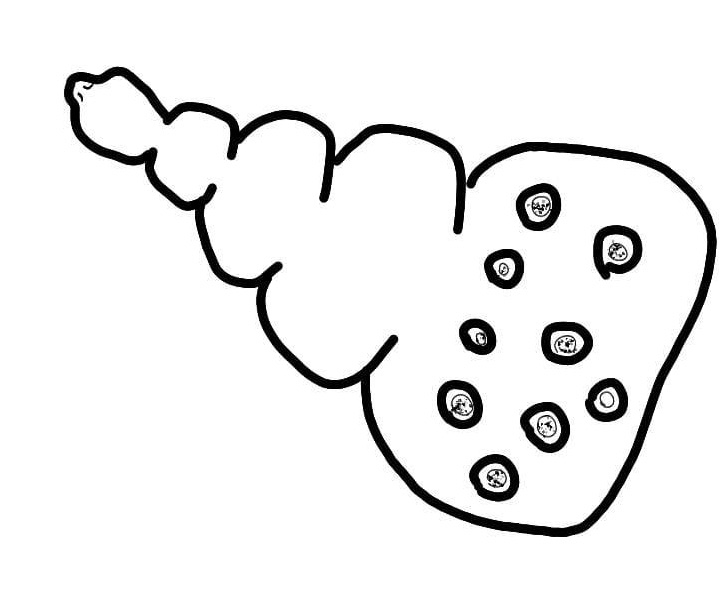
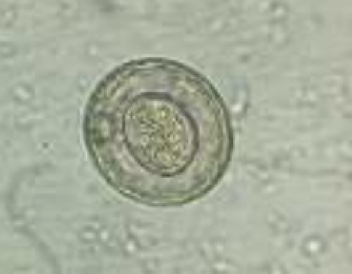
Identificazione e Ciclo: Cestode di 3-4 mm formato da 4-9 segmenti in cui l’ultimo ospita le uova mature. SI trova nel piccolo intestino di polli e altri gallinacei e sfrutta i molluschi come ospiti intermedi.
Le proglottidi vengono emesse con le feci, si muovono sulla vegetazione e vengono mangiare dai molluschi dove si sviluppa il cisticercoide. L’uccello si nutre dell’ospite intermedio causando la liberazione delle tenie che aderiscono alla mucosa e iniziano lo sviluppo ad adulti (2-3 sett).
Sintomi: altamente patogeno per la forte adesione ai villi intestinali, grosse infestazioni causano danni alla mucosa, malassorbimento, emorragie, cali produttivi e debolezza generale.
Raillietina spp
Identificazione e Ciclo:
Verme piatto cestode di cui diverse specie sono patogene per gli avicoli, si stanziano nel piccolo intestino:
Raillietina cesticillus, lunghezza 13 cm e 1-3 mm larghezza, galline e tacchini
Raillietina echinobothrida, 25 cm x 1-4 mm e da malattia nodulare intestinale, trovata in galline, piccioni e fagiani
Raillietina tetragona, 25 cm x 1-4 mm
Raillietina bonini, 7 cm x 1.5 mm, piccioni.
Ciclo indiretti con uccelli domestici e selvatici come ospiti finali e diversi ospiti intermedi:
Raillietina cesticillus coleotteri
Raillietina echinobothrida formiche
Raillietina tetragona formiche e mosche
Raillietina bonini lumache
Ciclo simile a Davainea, gli ospiti intermedi ingeriscono i segmenti gravidi, che rilasciano le uova nel loro intestino dopo la digestione. Le uova si sviluppano quindi in cisticerchi nella cavità corporea degli ospiti intermedi. Gli uccelli li ingeriscono e si infestano con le giovani tenie.
Sintomi: Patogeni tendenzialmente con sintomatologia lieve e poco identificabile, in caso di grave infezione si verifica una crescita stentata, diminuzione della produzione di uova. L’infezione cronica provoca diarrea, emaciazione e anemia causata da piccole emorragie intestinali croniche.
GESTIONE DEI CESTODI
Le infestazioni da Cestodi o, come più comunemente detto, da tenie, è spesso facile da individuare per la presenza di proglottidi mobili nelle feci. Non è detto però che non vederle significhi non avere il problema, non tutte le deiezioni le contengono e la loro emissione non è regolare.

Utile evitare ristagni idrici che possano attirare invertebrati (ospiti secondari), cambio frequente della lettiera in modo da mantenerla asciutta e povera di feci (questo aiuta a evitare le infezioni accorciando la sopravvivenza dei segmenti gravidi e delle uova). Sono consigliabili misure per evitare la contaminazione del mangime con formiche o coleotteri come non eccedere con il mangime ed utilizzare mangiatoie chiuse anti spreco. Può essere consigliabile il controllo chimico di mosche, formiche e termiti nei pollai in cui vi sia presenza massiccia.
Esaminare le feci per la presenza di proglottidi (solitamente ancora mobili e ben identificabili) nelle feci.
Come per i precedenti effettuare un esame parassitologico all’inizio della primavera e dell’inverno è una procedura importante per monitorare lo stato del pollaio e cogliere patologie precocemente.
In caso di parassitosi conclamata contattare il veterinario per la prescrizione del farmaco adeguato.
PERCHE’ PORRE COSÌ TANTA ENFASI SUL TRATTARE SOLO CON CONFERMA DI PARASSITOSI??
Ci preme stressare il concetto di trattamento mirato perché, come già succede per i trattamenti antibiotici, anche gli antiparassitari possono diventare con il tempo inefficaci sui parassiti.
Un uso indiscriminato senza seguire le posologie, a dosaggi sbagliati e/o non necessario di queste sostanze aumenta il rischio di sviluppo di resistenza nei parassiti, questo nel tempo porta alla perdita di molecole utili che non è detto abbiano un sostituto altrettanto efficace.
Fondamentale quindi trattare con il farmaco migliore per il parassita, nel dosaggio adeguato e rispettando le istruzioni di posologia del prodotto (compresi i tempi di sospensione per consumo di carne e uova degli animali trattati).
Usare un farmaco in modo improprio è un pericolo! Esistono parassiti che possono infettare l’uomo e alcune molecole usate in zootecnia sono le stesse usate nella medicina umana. Usando correttamente i principi attivi proteggiamo i nostri farmaci, i nostri animali e noi stessi.
RIMEDI DELLA NONNA?

Noi di Confraternita Gallus amiamo molto le nostre nonne ed i nostri nonni… ma a meno che siano veterinari/e evitiamo di accettare consigli sulla gestione medica da questi dolci vecchini.
Semi di zucca, aglio, decotti di aceto, erbe di campo, ortiche oli vari… sono tutti ottimi ingredienti per una cena con gli amici ma non presentano nessuna rilevanza medica per la gestione dei parassiti.
Una volta i farmaci non erano reperibili e per molti patogeni non esistevano proprio, si ricorreva quindi a sistemi raffazzonati che sfruttavano più l’effetto placebo di “aver fatto qualcosa” che metteva il cuore in pace al proprietario degli animali.
Potreste quindi chiedevi “Perché allora quando uso questi rimedi dopo qualche giorno gli animali sembrano stare meglio?”. La risposta è semplicemente legata all’interazione ospite-parassita. Le parassitosi più comuni raramente hanno conseguenze letali, soprattutto quando la problematica è limitata, e quando dopo qualche settimana dal “trattamento” gli animali si riprendono per la loro stessa risposta immunitaria… ecco che si dà il merito al rimedio della nonna. Ovviamente in quei casi in cui il problema sia troppo massiccio alcuni animali possono comunque morire, ma si giustificheranno istintivamente queste perdite come “animali già deboli” e non contemplando l’inefficacia del decotto datogli.
Ora abbiamo mezzi, indagini e principi attivi accessibili con comprovata efficacia. USIAMOLI! Ma sempre con cura e criterio!
Dr.ssa Donneschi Anna
Bibliografia:
https://www.ncvetp.org/
Patologia aviare X Ed; B. W. Calnek
Veterinary Clinical Parasitology di Anne M. Zajac; Gary A. Conboy; Susan E. Little; Mason V. Reichard.
Vimalraj Padayatchiar Govindan & Latchumikanthan Annamalai, 2019. “Tetrameres SP. (Spiruridae) from Backyard Chicken (Galliformes: Phasianidae) in Puducherry – A First Report,” Environmental Contaminants Reviews (ECR), Zibeline International Publishing, vol. 2(2), pages 15-16, December.
Erez, Mahmut & Bozkurt, Mehmet & YAPRAKCI, Mustafa Volkan & Göksu, Ahmet & Kozan, Esma. (2017). A Case of Dispharynx nasuta (Rudolphi, 1819) In a Long-eared Owl (Asio otus). 10.5578/kvj.54153.
Trismiharto, Akbar & Utama, Suzanita & Supranianondo, Koesnoto & Poetranto, Emmanuel & Koesdarto, Setiawan & Yunus, Muchammad. (2019). Identification of Worm Eggs in Faeces of Egrets (Egretta sp.) in Surabaya. Journal of Parasite Science. 2. 51. 10.20473/jops.v2i2.16399.


Lascia un commento